 Chemisches Gleichgewicht
Chemisches Gleichgewicht
Im chemischen Gleichgewicht einer bestimmten Reaktion werden die Konzentrationen der Reaktionspartner und Produkte durch den Betrag der Freien Enthalpie (G) dieser Reaktion bestimmt.
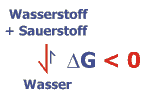
Für das Beispiel der Reaktion von Wasserstoff und Sauerstoff zu Wasser hat die Freie Enthalpie einen großen negativen Betrag. Deswegen liegt das chemische Gleichgewicht weit auf der Seite des Reaktionsprodukts. Die explosionsartige Reaktion ("Knallgasreaktion") wird bereits durch einen kleinen Funken ausgelöst. Andere Reaktionen benötigen jedoch eine größere Aktivierungsenergie, bevor sie ihr chemisches Gleichgewicht erreichen. Deswegen ist Holz zum Beispiel unter normalen Bedingungen stabil, obwohl das Gleichgewicht für seine Verbrennung (für die Reaktion mit Sauerstoff) ebenfalls weit auf der Seite der Produkte liegt.