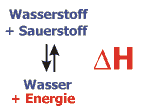
 Enthalpie (H)
Enthalpie (H)
Die Enthalpie (zu deutsch "Wärmetönung") entspricht der Energie, die bei einer chemischen Reaktion freigesetzt (negatives Vorzeichen) oder verbraucht (positives Vorzeichen) wird.
In Kombination mit der Änderung der Entropie bei einer chemischen Reaktion erlaubt die Kenntnis der Enthalpie die Vorhersage, in welche Richtung diese Reaktion ablaufen kann (Freie Enthalpie).
Im Beispiel ist die Reaktion von Wasserstoff und Sauerstoff zu Wasser dargestellt. Bei dieser "Knallgasreaktion" wird eine grosse Energiemenge frei. Im Vergleich dazu fällt die Änderung der Entropie kaum ins Gewicht. Das Gleichgewicht der Reaktion liegt also stark auf der Seite der Bildung von Wasser. Beim Vermischen von Wasserstoff und Sauerstoff genügt ein Funke – der die geringe Aktivierungsenergie überwindet – um die explosionsartige Reaktion auszulösen. Unter bestimmten Bedingungen (und dem Einsatz von Energie) ist es aber auch möglich, die Reaktion umzukehren und Wasser in Wasserstoff und Sauerstoff zu zerlegen.