 Entropie (S)
Entropie (S)
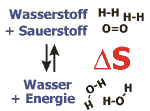
Die Entropie entspricht dem Zustand der Unordnung eines bestimmten Systems.
Im Beispiel ist die Reaktion von Wasserstoff und Sauerstoff zu Wasser dargestellt. Bei dieser "Knallgasreaktion" nimmt die Zahl der vorhandenen Moleküle ab, die Ordnung nimmt also zu. Da bei der Reaktion jedoch eine große Energiemenge freigesetzt wird, kann die Bildung von Wasser trotzdem spontan ablaufen.
Bei chemischen Reaktionen kommt es zu Veränderungen des Ordnungszustandes, wenn sich die Anzahl der vorhandenen Moleküle verändert. (Je weniger verschiedene Moleküle ein System enthält, desto größer ist die entsprechende Ordnung des Systems.) Nach dem zweiten Hauptsatz der Thermodynamik verlaufen alle Vorgänge freiwillig, bei denen die Ordnung abnimmt, die Entropie also zunimmt. Zur Beurteilung von chemischen Reaktionen ist neben der Veränderung des Ordnungszustandes der beteiligten Moleküle (S) allerdings noch die bei der Reaktion verbrauchte oder freiwerdende Wärmeenergie (H) entscheidend, weil sie zu einer Veränderung des Ordnungszustands der Umgebung führt (siehe Freie Enthalpie).