 Isotope
Isotope
Atome mit identischer Anzahl an Protonen und unterschiedlicher Anzahl an Neutronen.
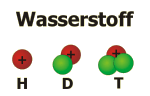
Im Beispiel sehen Sie die natürlich vorkommenden Isotope des Elements Wasserstoff. Da die Neutronen im Atomkern die Elektronenhülle der Atome nicht beeinflussen, haben sie auch keinen Einfluss auf die chemischen Eigenschaften der Atome – sie gehören zum gleichen chemischen Element. Alle Isotope mit einem Proton im Atomkern gehören beispielsweise zum chemischen Element Wasserstoff.
Beim Wasserstoff sind allerdings die Massenunterschiede zwischen den Isotopen besonders groß, weswegen man sie mit eigenen Namen bezeichnen kann: Deuterium (D) für das Isotop mit einem Neutron (Massenzahl 2), Tritium (T) für das Isotop mit zwei Neutronen (Massenzahl 3).
Atomkerne sind nur stabil, wenn die Anzahl an Protonen und Neutronen nicht zu groß ist und wenn diese beiden Kernbestandteile in einem "ausgewogenem Verhältnis" vorliegen. Isotope, bei denen dies nicht der Fall ist (wie zum Beispiel beim hier dargestellten Tritium), zerfallen unter Abgabe energiereicher Strahlung (Radioaktivität). So existieren bei den verschiedenen Elementen immer nur einige wenig stabile Isotope, die im wesentlichen immer im gleichen Verhältnis zueinander vorkommen. Wasserstoff zum Beispiel besteht natürlicherweise nur zu 0,015 Prozent aus Deuterium und enthält winzigste Spuren des radioaktiven Tritiums, 99,985 Prozent hingegen entsprechen dem Isotop ohne Neutronen im Atomkern.